2. Conceptos
Osmolalidad. La Osmolalidad se define como el número de Osmoles de soluto por kilogramo de
solvente. Número total de partículas disueltas/L
de disolución. Como los procesos biológicos se llevan a cabo siempre a temperatura prácticamente
constante, esta forma de expresar la presión osmótica casi no se usa en Bioquímica.
Las osmolaridad son muy importantes tanto a nivel celular como en cada órgano.
Ejemplos:
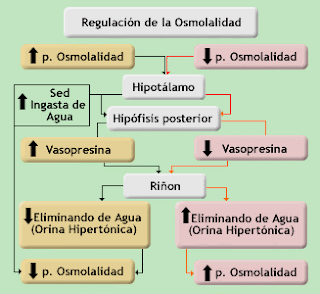
La osmolaridad del riñón:
Mantenimiento de la osmolaridad de la sangre: Regulando por separado tanto la
pérdida de agua como la de solutos en la orina, los riñones mantienen en la
sangre una osmolaridad relativamente constante cercana a 290 miliosmoles por
litro. Regulación de la composición iónica de la sangre: Los riñones ayudan a
regular la concentración de distintos iones de la sangre, principalmente los iones
de sodio, potasio, calcio, cloruro y fosfato.
Ósmosis: difusión de agua a favor de gradiente entre dos disoluciones con distinta
concentración de solutos separadas por una membrana semipermeable.
Presión osmótica: es la presión hidrostática que es necesario aplicar para evitar el
flujo osmótico entre dos disoluciones separadas por una membrana
semipermeable.
Soluciones.
Solución Hipotónica.
Esta solución contiene una baja concentración de soluto en relación con la concentración del citoplasma. En este caso, el agua se difunde desde la solución al interior de la célula, el volumen de la célula iría aumentando y podría llegar a explotar. Esto lo podemos ver en los seres humanos por medio de un proceso que se llama hemólisis cuando ocurre en los glóbulos rojos de los seres humanos, cuando la membrana celular de los glóbulos rojos se rompe, se libera la hemoglobina.
Solución Hipertónica.
Si una membrana semipermeable separa
una solución con una concentración más elevada de sustancias disueltas de otra
con una concentración menor de solutos se le llama “Hipertónica” (el prefijo
hiper significa “exceso”). Si dos disoluciones tienen diferente presión
osmótica, se dice que la disolución de mayor concentración es hipertónica.
Soluciones Isotónicas.
Las disoluciones isotónicas son aquellas donde la concentración del soluto es la misma en ambos lados de la membrana (dentro y fuera) de la célula por lo tanto la presión osmótica en la misma disolución isotónica es la misma que en los líquidos del cuerpo y no altera el volumen de las células. Es una sustancia con una concentración de sólidos igual a la concentración interna de sólidos de la célula, donde se aplique. Es importante que de ser necesario se inyecten medicinas en disoluciones isotónicas porque de lo contrario algunas de sus células podrían afectarse.Otro tipo de disoluciones isotónicas las podemos ver reflejadas en disoluciones fisiológicas como los sueros que se emplean para remplazar los líquidos del organismo. Generalmente los sueros presentan la misma presión osmótica, aunque algunos de sus componentes sean diferentes al tipo de partículas de la células.

Comentarios
Publicar un comentario